2021-12-08
心脏节律管理(CRM)是临床和资本市场的大热点,上市企业的“必争之地”。美敦力、雅培重压心脏节律业务,打造心血管板块的“重头戏”,而国内微创医疗收购LivaNova的心脏节律管理业务。
心脏节律管理指诊断、治疗和管理心律失常及心力衰竭,主要设备有起搏器、除颤器和心脏再同步治疗装置。心脏节律管理集心脏电生理、生物工程学、材料学、电子工程学等前沿学科于一体,门槛极高。我国CRM市场长期处于进口垄断的状态,国产品牌有待突破。
从心律管理领域的技术制高点ICD(植入型心律转复除颤器)入手,苏州无双医疗设备有限公司(以下简称无双医疗)搭建了CRM全产品线,ICD、ICM(植入式心电记录仪)、双腔起搏器均具有自主知识产权。自2017年成立以来,公司成功填补国产ICD空白,在研ICD产品已取得济南检验所的生物检测报告。
国产替代正盛的CRM市场,无双医疗是如何跑出一条路,产品布局逻辑是怎样的?在AED(自动体外除颤器)广受关注的同时,ICD市场会如何发展?为此,动脉网对无双医疗联合创始人平利川进行了专访,共同探讨大企业垄断格局下中小CRM企业的国产创新之道。
创——高门槛CRM市场国产替代潜力大,ICD是“重头戏”
动脉网:无双医疗最初怎么会想到进入心律管理市场?在国内CRM市场处于进口垄断的情况下,大企业可通过并购快速进入市场,那国内小企业的突破口在哪里?
平利川:心律失常是一种很常见的心血管疾病。全世界因心律失常而导致心源性猝死的案例占了所有心血管疾病相关患者的一半死亡原因,以及全球死亡原因的15%。我国每年心源性猝死的发病人数高达54.4万人,大约每一分钟就会有一个人因心源性猝死而倒下,但救治成功率远不足1%。
以起搏器和ICD为代表的CRM产品是三类有源植入器械领域的鼻祖,历史悠久且临床证据充分。这是一个庞大的市场,据GlobalData分析,2018年全球心脏节律管理市场规模预计可达到约143亿美元,美敦力、雅培都在持续加强其CRM业务。
在美国,关注心动过缓的各类心脏起搏器的植入量长期稳定在20万台/年,关注心动过速的各类心脏除颤器的植入量也基本稳定在20万台/年。
而在我国,CRM市场的发展远远不足。2017年,我和公司的联合创始人洪峰博士创办无双医疗。彼时,国内心脏起搏器的年植入量是美国的40%,国产品牌市场占有率仅2%;心脏除颤器的年植入量只有美国的5%,并且没有国产除颤器。
从国产替代的角度来看,CRM无疑是一个非常有吸引力的方向。我国CRM市场长期被进口产品垄断,ICD更是处于国产空白。在国内外心源性猝死预防指南或专家共识中,ICD都被推荐为“唯一有效”的手段。即使到今天,我们也没有看到任何器械或者药有可能进入指南或专家共识的I类推荐。
在综合考虑临床证据、市场潜力、国内外参与者的基础上,我们选择以ICD切入CRM市场。ICD产品本身兼具除颤和起搏的功能,是CRM领域的技术制高点,我们希望通过自主研发的ICD产品把心律管理技术平台攻克下来。
在2017年5月11日,我和洪峰正式立项做ICD,当时团队中仅有我们两名全职人员。
在发展过程中,我们遇见了太多挑战和质疑。最初融资时,让我非常意外的是,我当时谁也不认识,但很多投资人都愿意见我。但有一次,一位投资人说,之所以叫我来仅是出于好奇,想看谁会做ICD这么难的东西,并没有要投资的想法。
当时大家给我的普遍反馈是,你连起搏器都没做过,怎么可能把ICD做出来?而且大企业通过收购国外成熟公司或与跨国巨头合作,是可以很快拿出产品的,无双医疗这样一个小企业即使做出产品,怎么和大企业竞争?
在发展过程中,无双医疗坚信两个观点:第一,创业公司的方向就是锚定一个点,耐心精进,自己做出来的东西才不容易被卡脖子;第二,我见证了几个三类有源器械国产化与打市场的过程,借助资本的力量小企业可集中发力,在巨头面前仍有优势。
研——从难度最高的ICD入手,五次迭代“有迹可循”
动脉网:ICD是CRM领域技术难度最高的产品,您认为ICD的研发难点在哪里?无双医疗的ICD设备经历了多次迭代,在研发过程中有什么重要的时间节点?
平利川:从2007年起到2017年初,我和洪峰都是从事人工耳蜗的研发与国产化,也接触了一些神经刺激器产品的研发。在美国,神经刺激器领域的硬件平台,包括电极导线都已经非常标准且常见,企业发展的重点在于神经科学家和临床人员对疾病的钻研,但我们并没有看见现成的起搏器或除颤器的硬件平台。
当时对我们来说,既没有现成的技术可以借鉴,也没有心脏领域的知识积累,做ICD相当于从零开始。
ICD产品是由很多难度较高的单项技术组成的复杂系统,从高效率的高压充放电模块、导线的药物缓释系统到程控的UI设计,都需要不断钻研、改进。接下来,我按时间顺序分享一下无双医疗开发ICD产品的过程,在这之中我们可以看到ICD研发的几道坎。
创业初期,当务之急是解决高压充放电的问题。2017年12月,我们做出了第一个高压模块,大概有一个手掌大,和AED的电路非常相似。
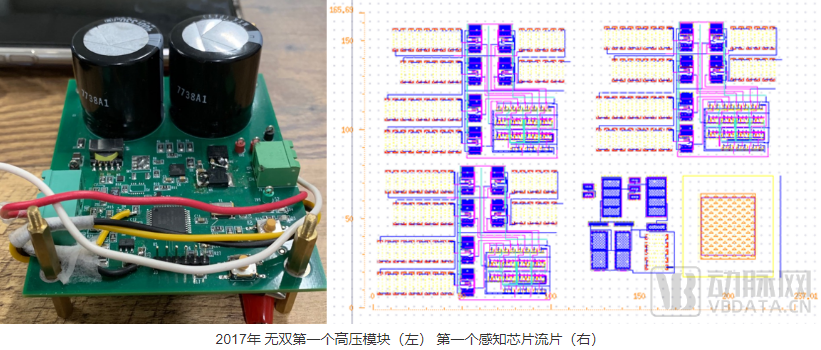
我们采购植入式心脏电极导线,配合我们自己的电路,在上海做了第一次大型犬的动物实验。医生将导线通过静脉植入比格犬心腔后,连接了我们的电路,成功消除了比格犬的室颤。

这里说个后话,在后续的4年中,我们共经历了5次高压模块关键裸芯(DIE)停产或是供应商鉴于和巨头的关系无法供货,但我们一直都在改进这个模块。现在,无双的高压模块从巴掌大变成了仅有大拇指盖的大小,几乎所有的关键器件都实现了替换,核心控制都是我们自己写的时序控制,真正掌握了研发和生产的自主权。
之后,我们的第二代原型完全是在车库里用一些简易设备,像车床、小型冲压机、小型注塑机手工做出来的,希望验证一个简单的“全套植入系统”。
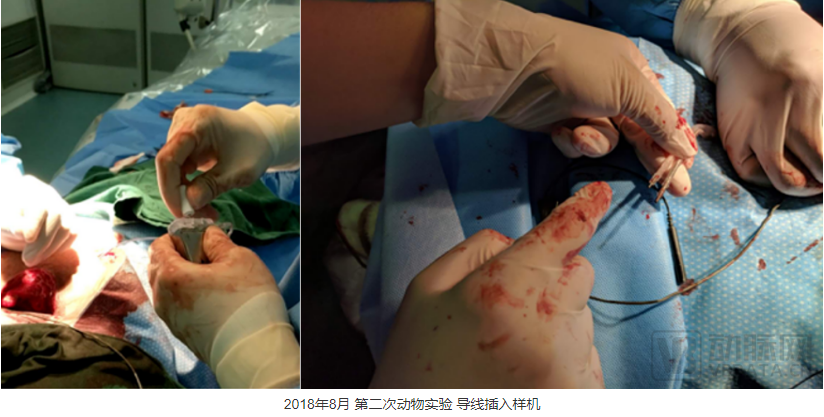
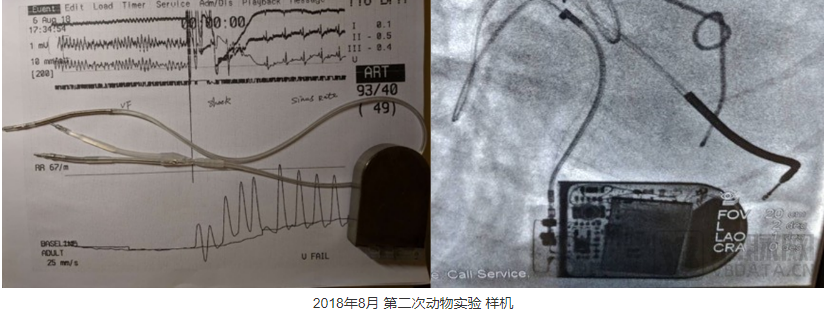
2018年8月份,在做第二次动物实验时,我们不仅实现了400MHz的无线通讯,在自己的软件界面上可以看到ICD设备传送回来的心电信号,而且我们在实验中,分别使用了车库里做出的简易的电极导线和采购的电极导线,分两次对实验狗进行诱颤除颤,都取得了成功。
2019年9月,我们做出了第三版ICD原型机,它在电路架构、外壳、工艺上都开始真正像一款ICD产品了。这一年我们的研发重点放在起搏功能上。
第三次动物实验中,我们完成了多种方式的诱颤,测试了我们那一年重点攻关的VVI(心室起搏、心室感知、按需起搏)功能和一些高阶功能,例如小电流测试除颤阻抗等,尝试完成了一次除颤阈值的测量(DFT测试)以及多次抗体外除颤的测试。
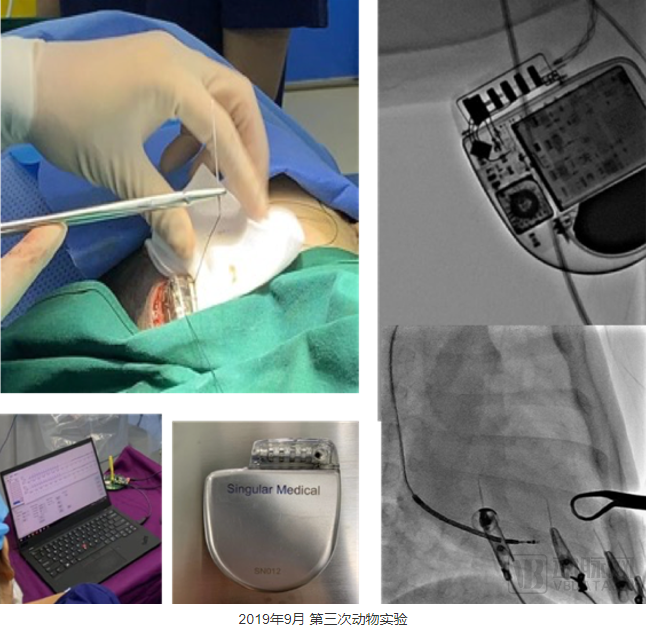
正因为前三年“无知者无畏”的探索,无双医疗的ICD设计与国外公司在技术路径几乎没有重合的地方,尤其是高压充放电、起搏以及感知系统。大公司的核心设计大部分是多年前形成的,并且已经封装到专用芯片中;而我们的系统设计是基于当前的半导体技术,最大限度使用成熟的商用芯片来实现我们的系统。
在ICD感知识别算法方面,我们使用了很多已经过期专利的方法,既保证了这些方法已经临床使用多年,也不涉及侵权。我们采用心脏模拟器、数据库等多种方式来测试这些算法组合,最终择优,以达到最好的效果。
2020年初,新冠疫情来临,我们在美国和国内的一些工作无法正常进行。本来预期2020年2月要完成苏州洁净厂区的验证,但受供应商影响,直到2020年9月底,才完成设备进场和验证。美国研发中心受影响更大,整一年无法进办公室工作,对外的合作和供应链也非常受影响。
但在此期间,我们还是开发出第四版的ICD样机,这款产品完全由我们自己在苏州生产,当时计划要向临床迈进。

但是,在我们和一些专家讨论后,大家认为现有ICD还有一些可提升的地方。其一,这一版本的ICD外形对瘦的病人而言,皮下突出会比较明显,ICD外形最好更圆弧圆润;其二,2020年7月FDA首次批准一款蓝牙连接ICD产品,我们的ICD产品最好配备蓝牙功能,而不是我们之前使用的400MHz通讯;其三是ICD产品的MRI兼容设计,临床特别依赖MRI检查。
公司董事会决定,我们等一年,要把更优质的新一代产品推向临床。
最终,我们形成了2021版的ICD。这款产品采用流线型设计,MRI兼容(还需验证)且配备蓝牙功能。这一年,我们聘请了几位退休的CRM网络安全专家,为无双构建了先进的网络安全系统,从特殊的蓝牙唤醒方式、交换密钥、加密等各个方面都与国际最先进的理念一致。
而且,2021年初我们和美国一家专注于医疗器械知识产权的律所合作,审查了ICD的设计(包括外观),在充分调研其它公司专利的基础上,可以开具产品不侵权的书面文件。

无双的产品研发路径与突破都是一步一个脚印,有迹可循的。在产品研发、验证、工艺、生产的各个方面,无双医疗都完全掌握自主知识产权,且实现了一定的领先。公司也从最初的2人,发展到如今的中美两个团队100人,构建了较高的人才壁垒。
后续,公司将在专业CRM团队的加持下,基于ICD平台技术持续进行产品开发与迭代,并实现高标准的产业化。
望——前五年风雨兼程,后五年开花结果
动脉网:近年来,我国大谈国产替代,在高精尖的ICD市场,临床和资本会为国产ICD设备买单吗?心脏性猝死1.5级预防(在国际公认的一级预防适应证基础上,加入非持续性室速、频发室早、射血分数较低、晕厥或先兆晕厥四大高风险因子)的提出,进一步定位了ICD植入群体,对ICD产品的推广和应用有什么帮助?
平利川:首先我们要明确为什么谈国产替代。医生、患者、医保的最底层需求,是在安全有效的前提下做到便宜。如果国产化的医疗器械能够给他们带来实惠,并满足患者需求,那他们肯定是愿意用的。其次,波士顿科学、美敦力等跨国巨头已在中国铺垫多年,学会和企业也在基层普及ICD技术和心律管理知识,培养了一批掌握ICD技术的医生。
在中国医疗资源不均的情况下,高端医疗设备与技术集中于一线城市,能做起搏器和除颤器植入手术的基层医院较少。随着医疗资源下沉,在高端医疗器械国产化的过程中,市场的重心往往不在中心医院,心律管理的未来可能会在二三线城市的中小医院。这也是我们的机会,扩展增量市场,星星之火可以燎原。
国际公认的一级预防是针对未发生过心脏骤停的高危人群。二级预防是针对已发生过心脏骤停的幸存者,他们经历过死亡,植入ICD的意愿非常强烈。一些专家认为欧美指南中关于ICD设备的适应症太宽泛了,可能存在一定程度的滥用。
我国1.5级预防的初衷就是想把最危险的病人挑出来,让他们尽早植入ICD。在我国,符合一级预防或1.5级预防的人群要远远多于二级预防。
在2021年发布的《植入型心律转复除颤器临床应用中国专家共识》中,我们可以提取出三个重点:
1、聚焦Ⅰ类适应证,我们的使命。
2、ICD 1.5级预防,中国的,世界的。
3、单腔具备完善ICD功能。
无双医疗的ICD,就是为1.5级预防而生。我国心源性猝死高风险的病人群体足够大,随着临床指南的明确和DRG的实施,我们对ICD产品的推广非常有信心。
动脉网:在整个除颤领域,AED无疑是最受关注的,WCD(可穿戴式心脏复律除颤器)发展势头也正盛。我知道无双医疗也在开发WCD,那您对于WCD市场的看法是怎样的呢?
平利川:近年来,AED设备实现了非常迅速的发展,地方政策鼓励,国产品牌获批。从美国的经验来看,AED的发展会带动ICD的发展,提高公众对于心源性猝死和除颤的认知。AED解决的是公共安全,而ICD是“装在身体里的救护车”,针对个体健康。
按最新的《AHA/ACC/HRS室性心律失常处理与预防心脏猝死指南》,针对由于感染等原因需要移除ICD装置的病人,指南对WCD做IIa推荐的;对其他SCD风险高但不适宜植入ICD的患者,如等待心脏移植、既往40天内发生心肌梗死、新诊断的非缺血性心肌病、LVEF≤35%、既往90天内血运重建、心肌炎、继发性心肌病、全身感染等,属于指南IIb推荐。
目前,国内还没有实现商业化临床应用的WCD产品。
在我看来,WCD最具挑战的应该是临床路径。对于一个有心源性猝死风险的病人,无论他使用的是ICD或WCD设备,他都将生死相托,这个过程的临床验证是非常严肃的。
目前世界上唯一商业化的WCD设备是FDA在2001年批准的。查询FDA的官网,可以看到,第一款WCD在2001年7月完成了16个中心的289例非随机临床。今年8月份,FDA批准了Kestra公司的ASSURE WCD系统,采信了130+13例的两组临床结果,但获批后Kestra公司还需要在24个月内补充5000多例入组病人。
这样一个近期的、现成的临床路径,对我们开发WCD设备会非常有指导意义。同时,WCD的FDA临床经验以及获FDA批准的S-ICD(全皮下ICD)临床设计,会为我们ICD的临床提供非常重要的启发。
目前无双在研的有3款WCD产品,分别是贴片式、衬衣式和背心式,可适用于不同的场景。在WCD的研发上,在电池、电容供应商和心律管理技术方面的多年积累是我们的优势,我们的高压模块够小,整体体积甚至小于Element Science的产品。
从产品布局来看,我们聚焦个体心源性猝死的预防,WCD是ICD产品的补充。
动脉网:回顾前五年风雨兼程,无双医疗种下了专利和产品的“种子”,在后五年里,我们会有什么动作?
平利川:后五年,我们将不断去验证ICD产品在临床上的有效性,紧贴临床完善产品。而且,我们将加速开发创新起搏器、ICM系统,实现对CRM全产品线的覆盖。同时,我们希望通过自研、与友商合作加速布局WCD以及与心律失常相关的神经调控产品赛道。
此外,从2020年起,我们就在积极探索和布局数字医疗,包括AI诊断、远程随访等等,希望在2022年可以有产品展示出来。
参考资料:
《Mehra, R. Global public health problem of sudden cardiac death.. Journal of electrocardiology. 2007, 40 (6 Suppl): S118–22. PMID 17993308.》
《植入型心律转复除颤器临床应用中国专家共识(2021)》
《2017 AHA/ACC/HRS室性心律失常处理与预防心脏猝死指南》
《P010030 Lifecor, Inc. WCD® 2000 System Summary of Safety and Effectiveness Data》
《P200037 Kestra Medical Technologies, Inc. ASSURE Wearable Cardioverter Defibrillator (WCD) System Summary of Safety and Effectiveness Data》
阅读原文